肠菌移植:癌症辅助治疗的微生态调节新策略
近年来,随着微生物组学研究的深入,肠道菌群在肿瘤发生、发展及治疗中的关键作用日益受到关注。大量基础与临床证据表明,肠道菌群不仅通过调节宿主免疫、代谢及炎症状态影响肿瘤微环境,还显著调控包括免疫检查点抑制剂在内的多种抗肿瘤治疗的疗效与毒性。在此背景下,以肠菌移植(FMT)为代表的肠道微生态干预策略,正从理论探索迈向临床实践。
肿瘤疾病
宿主遗传、饮食、抗生素或应激等因素可致菌群失调,这种失衡会激活肠道内的炎症警报系统(如Toll样受体通路),促使免疫细胞释放多种促炎信号分子(如IL-23、TNF等),引发慢性低度炎症;同时,某些有害细菌产生的代谢物或毒素还可能损伤人体细胞的DNA,推动癌症的发生[1]。
肠道菌群作为信号分子,参与调控宿主血压、炎症及细胞功能。其代谢膳食纤维生成短链脂肪酸(如如乙酸盐、丙酸盐和丁酸盐),并通过刺激免疫系统发育,进而调控整体免疫功能[3,4],影响癌症免疫治疗效果[5]。
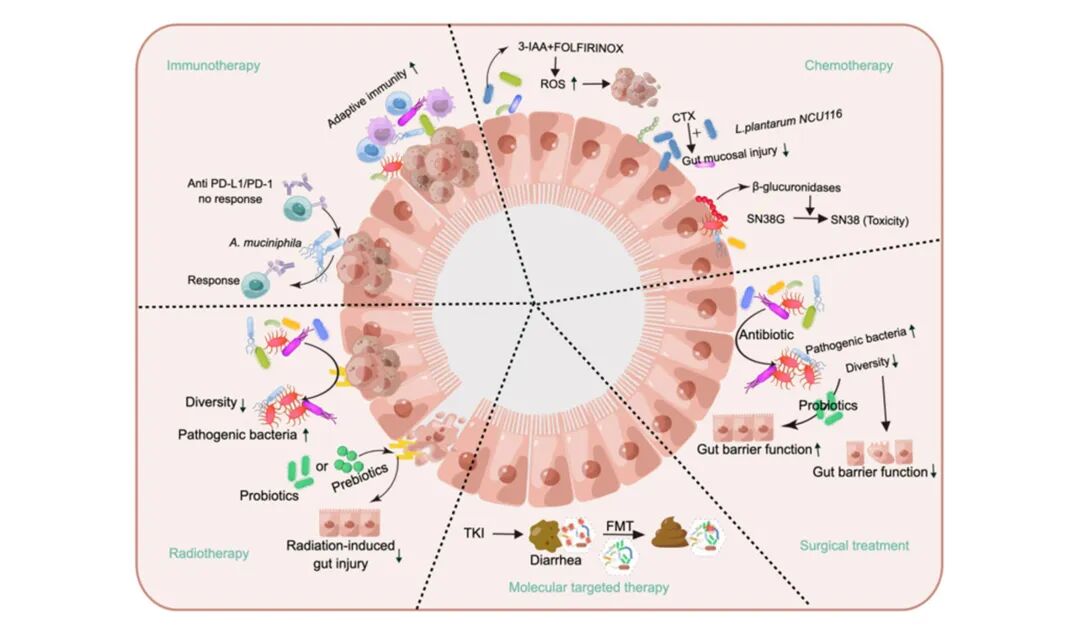
肠菌移植应用于肿瘤治疗[1]
研究表明,肠道微生物的组成会显著影响抗癌药物——免疫检查点抑制剂(如PD-1/PD-L1抑制剂)的疗效。通过FMT将健康供体的肠道菌群移植给患者,可改善治疗反应。有研究显示约翰逊乳杆菌与生孢梭菌协同增强细胞毒性T淋巴细胞功能,提升泛肿瘤对免疫检查点抑制剂的反应。抗PD-1/PD-L1抗体疗法为免疫检查点抑制剂治疗中的主流方案,与FMT联合治疗,疗效显著[5]。
胃肠道肿瘤
结直肠癌(CRC)是全球第四大常见恶性肿瘤[6],肠道菌群密切参与肿瘤微环境构建。菌群毒素介导癌基因激活和抑癌基因失活,驱动肿瘤发生[7,8],亦可塑造免疫抑制微环境,加速CRC进展[9]。此外,菌群失调相关炎症是结肠炎癌变的关键推手[10]。
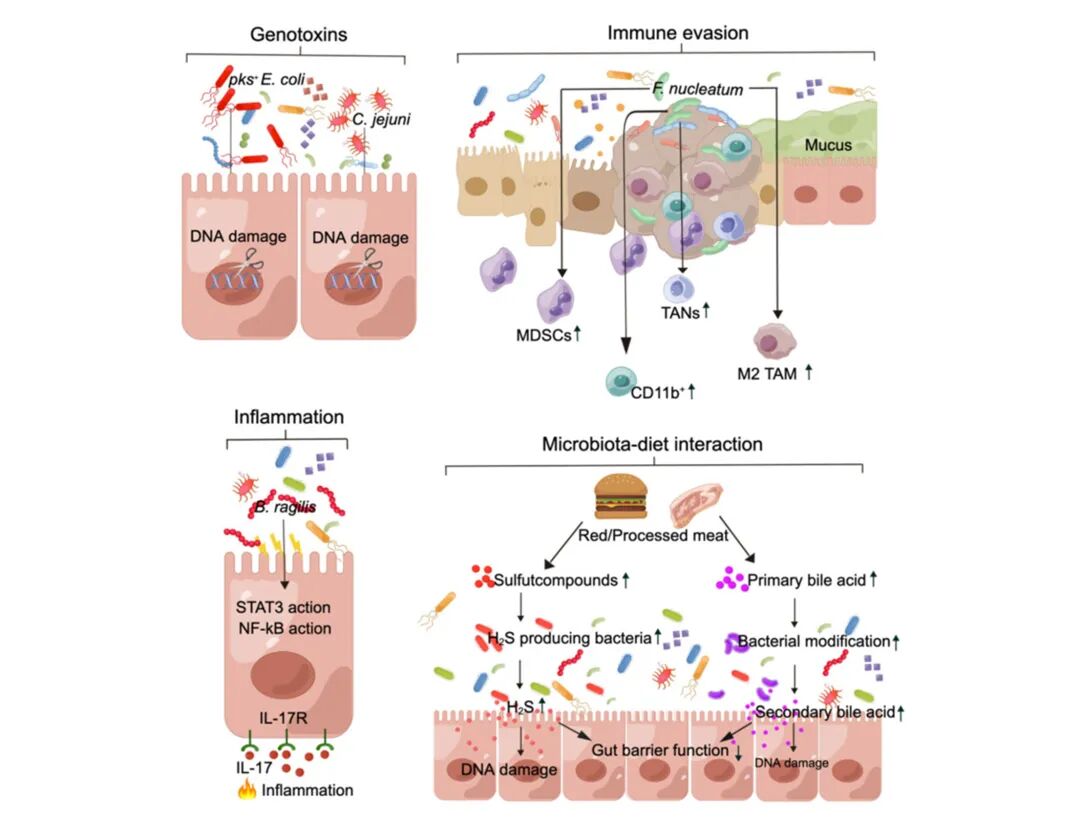
肠道菌群失调通过多种分子机制促进CRC的发展[6]
研究表明,结直肠癌治疗中FMT与免疫检查点抑制剂及靶向药协同增效。临床证实,微卫星稳定型转移性结直肠癌患者接受FMT联合替雷利珠单抗及呋喹替尼三联疗法,中位无进展生存期达9.6个月,中位总生存期13.7个月,客观缓解率提升20%,疾病控制率高达95%[11]。
肝细胞癌
肝脏通过门静脉暴露于肠道微生物中,门静脉传递肠道来源的细菌产物和毒素,肠道和肝脏之间密切的结构和功能相互作用被定义为“肠-肝轴”。研究显示,肠道细菌代谢物可以通过肠-肝轴促进慢性肝病和肝细胞癌发展[12]。
肝细胞癌(HCC)为全球第四大癌症死因,占肝癌的90%[13]。研究结果显示,HCC患者脂多糖(LPS)水平显著升高并伴随肠道屏障破坏[14,15],后者可促使肠道微生物源LPS经门静脉入肝,同时诱发肠道菌群失调,导致益生菌减少、病原菌增殖[17]。
FMT作为肝癌潜在疗法,调控肠道菌群抑制肝脏炎症与癌变[17]。于君团队发现,将肝癌、肝硬化患者粪菌移植至无菌或无特异性病原体的小鼠后,发现移植肝癌患者肠菌(HCC-FMT)的小鼠肿瘤直径最大、数量最多、负担最重[18]。
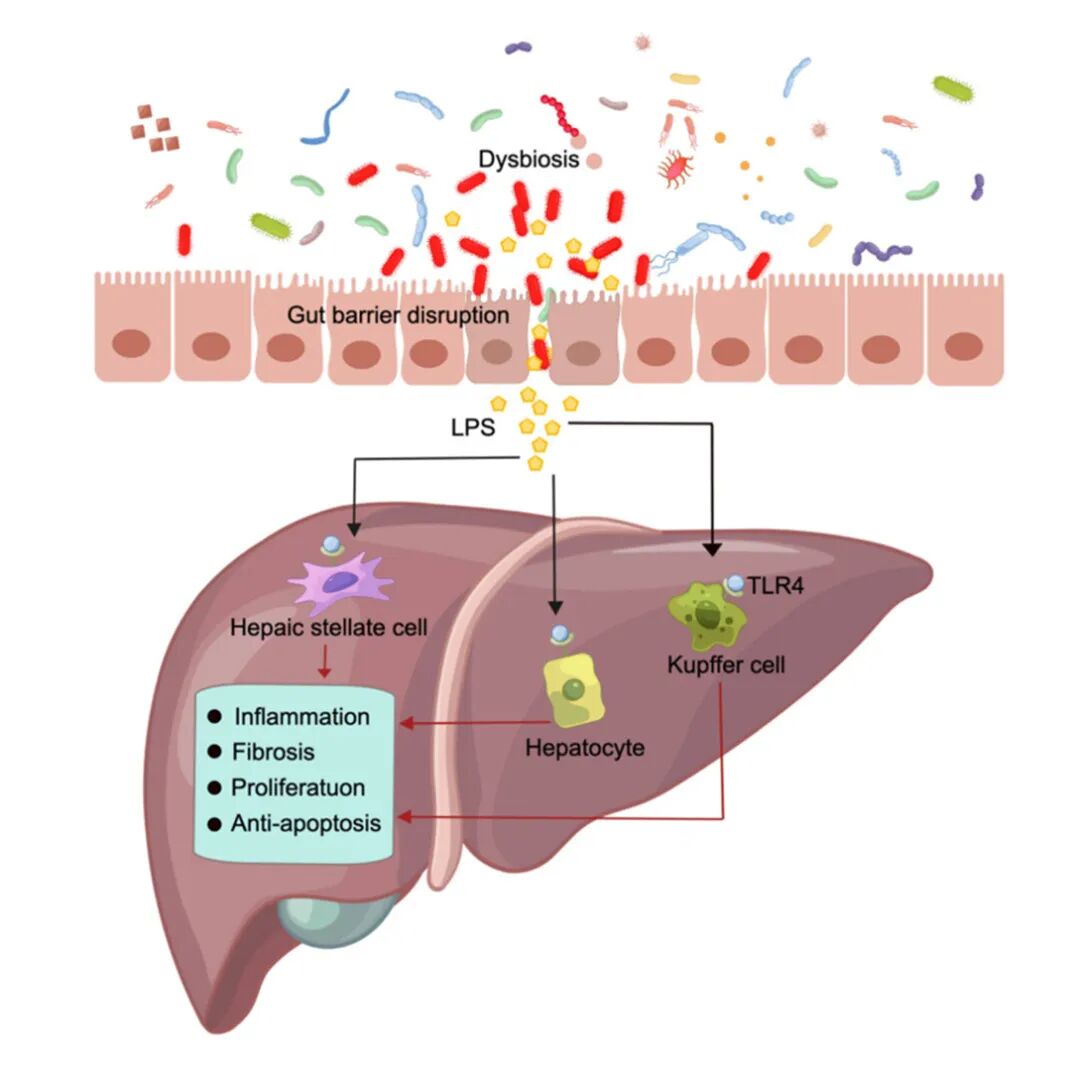
肠道微生物治疗肝癌的潜在机制[10]
乳腺癌
乳腺癌(BC)的发病率已超肺癌(LC),成为全球主要癌症类型。最新研究表明,肠道微生物群可能通过调控雌激素/孕激素解离与生物利用度影响BC发病机制,从而影响乳腺癌的发病率及治疗反应[19,20]。
Terrisse等人揭示肠道菌群与乳腺癌化疗响应相关:肠道特定共生菌影响预后和调控小鼠模型中肿瘤的侵袭性,化疗会重塑菌群结构、扰乱促/抑瘤微生物平衡[21]。
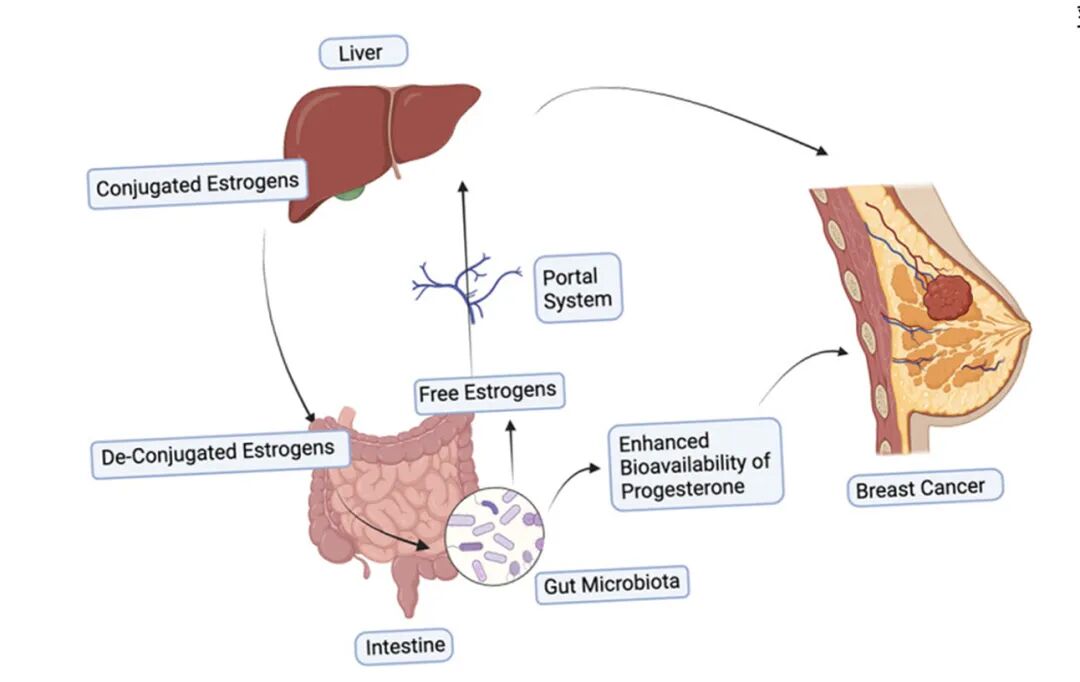
肠道微生物对乳腺癌的影响机制[20]
黑色素瘤
恶性皮肤黑色素瘤(CM)是致死率最高的皮肤癌类型之一,其全球发病率年增长率已超越其他所有恶性肿瘤[22]。FMT可对肠道固有层及肿瘤微环境中免疫细胞浸润与基因表达谱正向重塑,是突破难治性黑色素瘤患者免疫检查点抑制剂耐药瓶颈的潜在策略[23]。
一项I期临床试验显示,10例PD-1抑制剂耐药的恶性黑色素瘤患者接受FMT治疗后,1例获完全缓解,2例获部分缓解。这3例有效患者的肠道固有层与肿瘤微环境中均出现显著免疫细胞浸润[24]。另有研究证实,在黑色素瘤及免疫治疗难治性癌症患者中,FMT联合免疫治疗可显著提升生存率,甚至使部分肿瘤完全消退[25]。
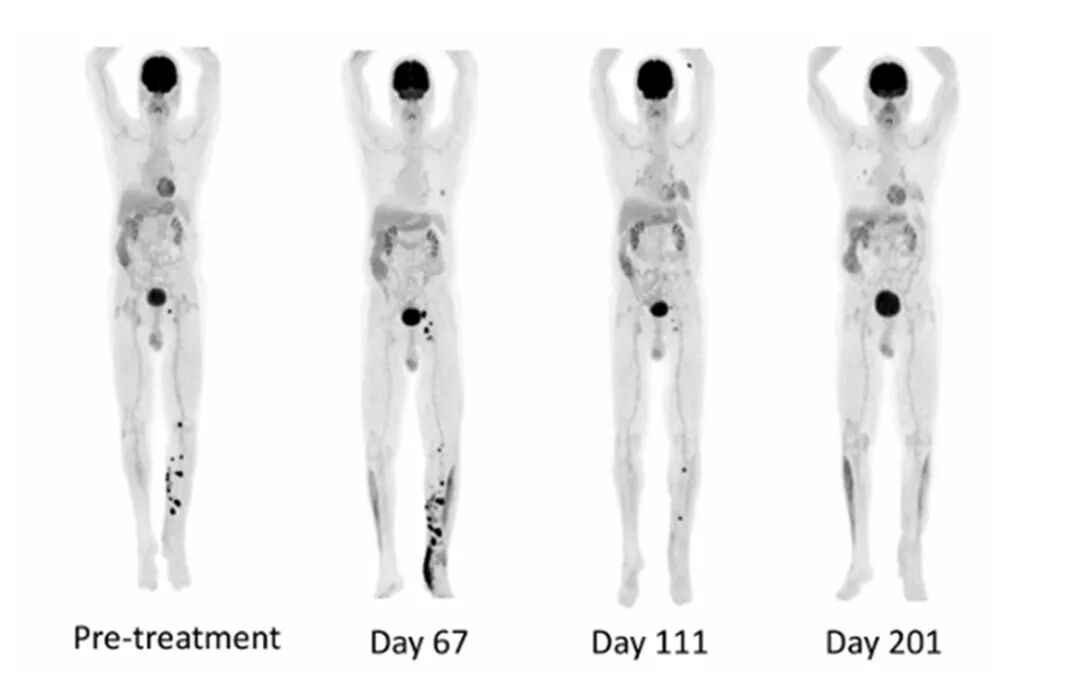
粪菌移植对黑色素瘤的治疗效果[24]
癌症相关并发症
放化疗损伤肠道菌群致其失调,破坏肠道屏障并增高通透性,引发全身炎症及不良反应[26];FMT通过移植健康供体的功能性菌群,重建菌群多样性与稳态,缓解相关炎症、肠道损伤与免疫抑制[27]。
肿瘤患者化疗后艰难梭菌感染(CDI)复发率高,FMT治疗有效率达86%且安全性良好,可恢复菌群稳态、缓解放化疗相关肠损伤与免疫抑制[28]。
《自然医学》发表一项研究,对免疫治疗所致严重结肠炎患者进行健康供体肠菌移植。两例患者接受治疗后,两周内首例结肠炎完全消退,第二例经两次治疗后完全恢复[29]。
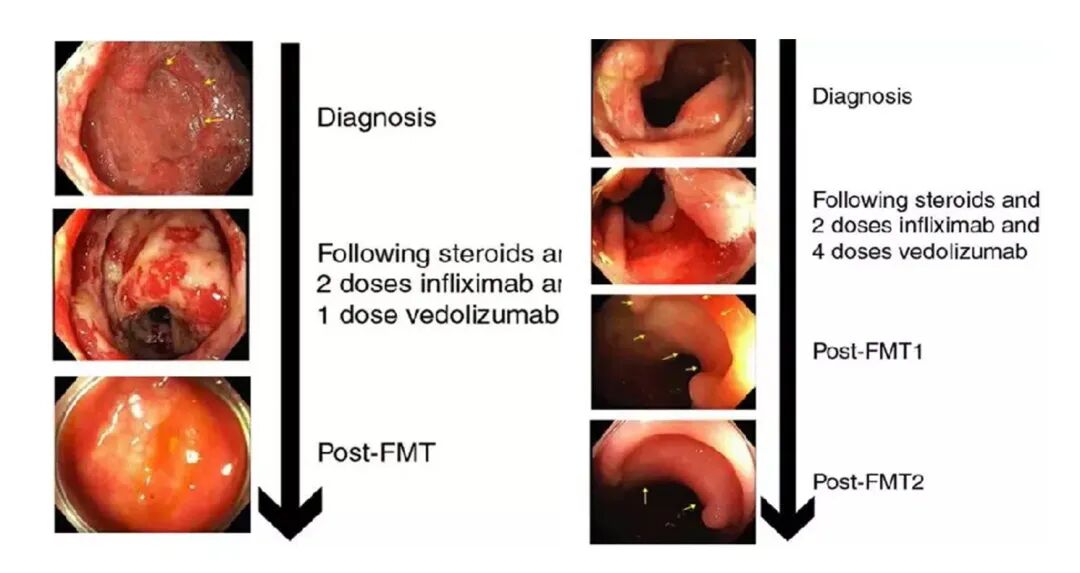
粪菌移植对放射性肠炎的治疗结果[29]
综上所述,肠道菌群作为连接宿主与环境的重要桥梁,在肿瘤的发生、进展及治疗响应中扮演着多重角色。FMT作为一种重塑肠道微生态的有效手段,不仅在提升免疫检查点抑制剂疗效方面取得突破性进展,还在缓解放化疗相关并发症、逆转免疫治疗耐药等方面展现出显著临床价值。随着微生物组研究向精准化方向发展,针对肠道菌群的干预策略有望在改善患者生存和生活质量方面发挥越来越重要的作用。
参考文献
[1]Chen D,Wu J, Jin D, et al. Fecal microbiota transplantation in cancer management: Curent status and perspectives. Int J Cancer.2019;145(8):2021-2031.
[2] Gopalakrishnan V, Helmink BA, Spencer CN, et al. The Influence of the Gut Microbiome on Cancer, Immunity, and Cancer lmmunotherapy. Cancer Cell.2018;33(4):570-580.
[3] McCoy KD, Geuking MB, Microbiota regulates intratumoral monocytes to promote anti-tumor immune responses. Cell.2021;184(21):5301-5303.
[4] Liu Q, Yang Y, Pan M, et al. Role of the gut microbiota in tumorigenesis and treatment. Theranostics.2024;14(6):2304-2328.
[5]于昕新,马春联,周世振,等.肠菌移植治疗肿瘤[J].中华胃肠外科杂志,2025;38(3):276-278.
[6]Sung H, Ferlay J, iegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin.2021;71(3):209-249.
[7]Nesić D, Hsu Y, Stebbins CE. Assembly and function of a bacterial genotoxin. Nature. 2004;429(6990):429-433.
[8]He Z, Gharaibeh RZ, Newsome RC, et al. Campylobacter jejuni promotes colorectal tumorigenesis through the action of cytolethal distending toxin. Gut. 2019;68(2):289-300.
[9]Cao Y, Oh J, Xue M, et al. Commensal microbiota from patients with inflammatory bowel disease produce genotoxic metabolites. Science. 2022;378(6618):eabm3233.
[10]Dong X, Pan P, Zheng DW, et al. Bioinorganic hybrid bacteriophage for modulation of intestinal microbiota to remodel tumor-immune microenvironment against colorectal cancer. Sci Adv. 2020 ;6(20):eaba1590.
[11]Zhao W, Lei J, Ke S, et al. Fecal microbiota transplantation plus tislelizumab and fruquintinib in refractory microsatellite stable metastatic colorectal cancer: an open-label, single-arm, phase II trial (RENMIN-215). EClinicalMedicine. 2023;66:102315.
[12]Liu Q, Yang Y, Pan M, et al. Role of the gut microbiota in tumorigenesis and treatment. Theranostics. 2024;14(6):2304-2328.
[13]Filliol A, Saito Y, Nair A, et al. Opposing roles of hepatic stellate cell subpopulations in hepatocarcinogenesis. Nature. 2022;610(7931):356-365.
[14]Zhou A, Tang L, Zeng S, et al. Gut microbiota: A new piece in understanding hepatocarcinogenesis. Cancer Lett. 2020 ;474:15-22.
[15]Yu LX, Schwabe RF. The gut microbiome and liver cancer: mechanisms and clinical translation. Nat Rev Gastroenterol Hepatol. 2017;14(9):527-539.
[16]Liu Q, Lu Y, Xiao Y, et al. Effects of Docetaxel Injection and Docetaxel Micelles on the Intestinal Barrier and Intestinal Microbiota. Adv Sci (Weinh). 2021;8(24):e2102952.
[17]Zhou D, Pan Q, Shen F, et al. Total fecal microbiota transplantation alleviates high-fat diet-induced steatohepatitis in mice via beneficial regulation of gut microbiota. Sci Rep. 2017 ;7(1):1529.
[18]Wang X, Fang Y, Liang W, et al. Gut-liver translocation of pathogen Klebsiella pneumoniae promotes hepatocellular carcinoma in mice. Nat Microbiol. 2025;10(1):169-184.
[19]董阿茹汗,张莹.肠道菌群与乳腺癌相关性研究进展[J].现代肿瘤医学,2021;29(3):539-542.
[20]Chapadgaonkar SS, Bajpai SS, Godbole MS. Gut microbiome influences incidence and outcomes of breast cancer by regulating levels and activity of steroid hormones in women. Cancer Rep (Hoboken). 2023;6(11):e1847.
[21]Terrisse S, Derosa L, Iebba V, et al. Intestinal microbiota influences clinical outcome and side effects of early breast cancer treatment. Cell Death Differ. 2021;28(9):2778-2796.
[22]Long GV, Swetter SM, Menzies AM, et al. Cutaneous melanoma. Lancet. 2023;402(10400):485-502.
[23]Routy B, Lenehan JG, Miller WH Jr, et al. Fecal microbiota transplantation plus anti-PD-1 immunotherapy in advanced melanoma: a phase l trial.Nat Med.2023;29(8):2121-2132.
[24]Baruch EN, Youngster l, Ben-Betzalel G, et al. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients.Science.2021;371(6529):602-609.
[25]Vongsavath T, Rahmani R, Tun KM, Manne V. The Use of Fecal Microbiota Transplant in Overcoming and ModulatingResistance to Anti-PD-1 Therapy in Patients with Skin Cancer. Cancers (Basel).2024;16(3):499
[26]缪明永.人体微生态与放疗之间的相互关系[J].肿瘤代谢与营养电子杂志;2022,9(1):7-11.
[27]Hefazi M, Patnaik MM, Hogan W,et al. Safety and Efficacy of Fecal Microbiota Transplant for Recurrent Clostridium dificileInfection in Patients With Cancer Treated With Cytotoxic Chemotherapy: A Single-lnstitution Retrospective Case Series. Mayo Clin Proc.2017:92(11):1617-1624.
[28]Ding X,Li 0,Li P,et al.Fecal microbiota transplantation: A promising treatment for radiation enteritis?,Radiother Oncol.2020;143:12-18.
[29]Wang, y, Wiesnoski DH, Helmink BA, et al, Fecal microbiota transplantation for refractory immune checkpoint inhibitor-associatedcolitis.Nat Med.2018;24(12):1804-1808.









